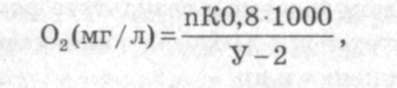|
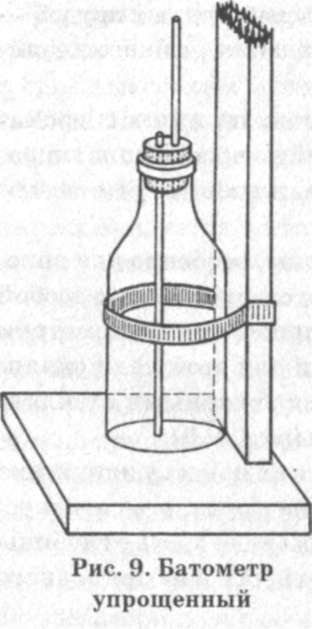
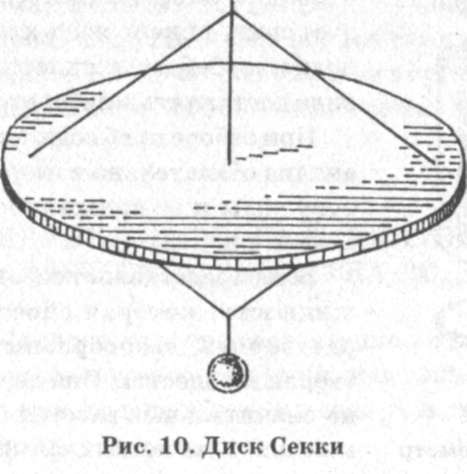
Природная вода содержит в растворенном и взвешенном виде определенное количество различных веществ. Комплекс этих веществ, содержащихся в воде, называют химическим составом. Знание химического состава воды рыбоводных прудов — обязательное условие успешного ведения рыбного хозяйства. Каждое рыбоводное хозяйство должно иметь гидрохимическую лабораторию, выполняющую простейшие гидрохимические определения и контролирующую тем самым производственный процесс. Пробы воды на химический анализ, особенно для определения растворенных в воде газов, следует брать с особой предосторожностью специальным прибором — батометром или специально приспособленными для этой цели склянками, укрепленными на шесте и снабженными стеклянными или резиновыми трубочками (рис. 8, 9). Отбор проб производят в трех местах пруда: у источника поступления воды в пруд, посредине пруда, у водовыпус-ка. При глубине пруда до 1,5 м пробы надо брать с глубины 25 см от дна, при 1,5-2 м — с поверхности и из придонного слоя. Важное значение имеет и время взятия пробы, так как в зависимости от времени суток меняется газовый режим воды, рН. Лучше всего пробы брать всегда в определенное время суток — утром. Хранить пробы для определения растворенных в воде газов нельзя. Пробу воды для определения кислорода следует сразу фиксировать хлороформом (в лодке, на берегу, на плотине) и в таком виде доставлять в лабораторию. При отборе проб воды на химический анализ обязательно измеряют температуру воды и ее прозрачность (по диску Секки, рис. 10). Вода представляет собой подвижную жидкость, которая способна быстро растворять газообразные, жидкие и твердые вещества. Она легко переносит на значительные расстояния необходимые для всех живых организмов хими-
ческие элементы и соединения, такие как соли для питания растительных организмов. Эти свойства воды делают ее незаменимой частью внутренней среды организма, обеспечивающей поступ ление во все ткани организма кислорода и питательных веществ, также удаление вредных продуктов. Чистой воды в природе не бывает, в ней всегда содержатся в растворенном или взвешенном виде многочисленные элементы и соединения. Особенно много (около 3,5%) растворимых солей содержит морская вода, где преобладают хлористый натрий (поваренная соль), соединения магния, серы (сульфаты) и другие. В морской воде в том или ином коли честве представлены практически все элементы, встречающиеся на земном шаре. Вкус морской воды — горько-соленый, и она непригодна для питья. Из-за высокого содержа-
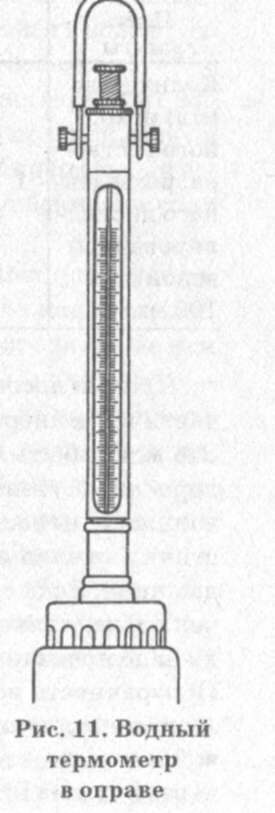
ния солей морская вода замерзает не при О °С, как пресная, а примерно при -2 "С. В воде внутренних водоемов растворено значительно меньше солей (около 0,1%, то есть не более 1 г на 1 кг воды)- Физические и химические особенности воды природных водоемов имеют большое значение для рыб. В этой связи рыбоводы должны иметь представление об основных физических свойствах и химическом составе воды, уметь определять эти свойства и направленно менять их с целью создания благоприятных условий для содержания и выращивания рыбы. Физические свойства воды. Температура воды, ее колебания играют большую роль в жизни рыб и других водных организмов, населяющих водоем. Большинство рыб, являющихся объектами прудового рыбоводства, живут в теплых водах. Поэтому резкие колебания температуры (на 8-12 °С) неблагоприятно влияют на жизнь водных организмов. При низких температурах рыба плохо усваивает корм и медленно растет, плохо развивается естественная кормовая база, задерживаются развитие эмбрионов и выклев личинок. Температуру воды измеряют водным термометром (лучше в металлической оправе) со шкалой от -3 С до +35-40 °С (рис. 11). Цвет воды в прудах зависит от содержания в ней органических веществ. Большое количество органических соединений растительного происхождения придает воде буроватый оттенок. Вода бурого цвета непригодна для снабжения зимовальных прудов и для разведения рыб. Использование такой воды для водоснабжения выростных прудов приводит к низкой естественной рыбопродуктивности- Темно-бурый цвет имеют болотные ВоДы, так как в них много гумусовых ве-
ществ. Цвет воды в прудах определяют с помощью шкалы. Это стеклянный цилиндр, заполненный для сравнения стандартным раствором. Лучше всего использовать для шкалы раствор хлорплатината калия и хлористого кобальта. Цвет воды выраясают в условных единицах — градусах цветности. Цвет более 40° является высоким. Такую воду не рекомендуется использовать для рыбоводных прудов. Готовят стандартный раствор так: отвешивают на весах 1,246 г хлорплатината калия (К2Р1С16) и 1 г хлористого кобальта (СоС12-Н20), растворяют в 1-литровой мерной колбе в небольшом количестве дистиллированной воды, добавляют 100 мл концентрированной соляной кислоты и объем доводят до 1000 мл. Цвет приготовленного раствора 500°. Из него готовят еще 13 стандартов по 100 мл:
Прозрачность воды зависит от количества взвешенных частичек минерального и органического происхождения. Это могут быть живые и отмершие микроскопические водоросли. Мутная вода непригодна для обеспечения зимовальных, нерестовых и других прудов. Взвешенные частички откладываются на жабрах рыбы и затрудняют ее дыхание. Вода с большим количеством взвешенных частичек отрицательно влияет на развитие икры рыб. Такую воду надо предварительно отстаивать в прудах-отстойниках. Прозрачность воды определяют с помощью белого металлического диска Секки, который опускают в воду с теневой стороны лодки. Диск крепят к веревке, размеченной через каждые 10 см. Опускают диск до тех пор, пока он пере- станет быть видимым, и поднимают до его появления. С установлением четкой видимости диска отсчитывают величину прозрачности воды, которая выражается в сантиметрах или в метрах. Прозрачность воды оценивают следующими показателями: совсем прозрачная, слегка мутная, мутная, сильно мутная и т. д. Запах воды. Если в воде есть различные добавки, которые имеют запах, то их можно определить органолептичес-ки, то есть при помощи органов чувств. Например, наличие фенола придает воде запах карболовой кислоты, наличие сероводорода — запах тухлых яиц. Вкус воды определяют при помощи вкусовых рецепторов ротовой полости. В зависимости от химического состава вода может иметь вкус сладкий, соленый, горький и др. Химические свойства воды. Качественный и количественный состав соединений, которые находятся в воде в растворенном виде, называют ее химическим составом. Прудовая вода по составу и количеству растворенных минеральных солей отличается от морской. В пресной воде их значительно меньше и они непостоянны. Минеральный состав пресной воды в основном определяют углекислые соли кальция и отчасти магния. Большое значение в жизни рыб имеет кислород, растворенный в воде. Для холодноводных рыб его надо больше, чем для тепловодных. Концентрация кислорода в воде для лососевых рыб должна быть не менее 8 мг/л, а для карпа — 5 мг/л. Однако в зависимости от времени года потребность рыб в кислороде различна. Так, жизненные процессы у теплолюбивых рыб (карпа, карася, линя и др.) в зимний период замедленны, поэтому они могут жить и при более низком содержании кислорода в воде — 2,0-2,5 мг/л. Кислород попадает в воду из воздуха или образуется растениями в самом водоеме в результате фотосинтеза. Кислород используется для дыхания водных организмов, идет на процессы гниения и др. Сеголетки карпа массой 25 г за 1 ч расходуют на 1 кг массы 413 мг кислорода. Поэтому при уплотненных посадках рыбы необходимо усилить контроль за кислородным ре- жимом водоема, принять меры для обогащения воды кислородом (увеличение водообмена, аэрация и т. д.). Количество растворенного в воде кислорода определяют по получившему широкое распространение йодометричес-кому методу Винклера. Этим методом можно определять кислород при концентрации его от 0,05 мг/л и выше. Определяют содержание кислорода в воде следующим образом. Водой из водоема три раза ополаскивают склянку (так называемую кислородную) объемом 100-150 мл, затем погружают стеклянный наконечник из батометра или сифона в склянку до дна и наполняют ее так, чтобы вода перелилась через край. Сразу же в склянку вводят пипеткой 1 мл раствора МпС12и 1 мл раствора КЛ^аОН. Пипетку каждый раз погружают сначала до половины склянки, а затем, по мере выливания, поднимают ее вверх. Для каждого раствора должна быть отдельная пипетка (помеченная любым способом!). После введения реактивов склянку закрывают пробкой, следя за тем, чтобы в ней не осталось пузырьков воздуха, и содержимое хорошо перемешивают многократным резким перевертыванием. В таком состоянии склянку с содержимым оставляют до титрования (на несколько часов, но не более одних суток!). Перед титрованием приливают 2 млН2804 (1:1)или 5 млНС1 (2:1).Склянку закрывают пробкой и содержимое тщательно взбалтывают до полного растворения осадка. После этого пробу переливают в коническую колбу объемом 250-300 мл и титруют 0,1 ^-раствором гипосульфита (Ка28203). Титруют (при непрерывном помешивании содержимого колбы) до окрашивания жидкости в слабо-желтый цвет, после чего прибавляют 1 мл свежеприготовленного раствора крахмала (жидкость окрасится в синий цвет) и продолжают по каплям титровать до исчезновения синей окраски. Содержание кислорода в воде вычисляют по формуле:
где п — количество 0,01 1Ч-раствора гипосульфита, израсходованного на титрование; К — поправка к нормальности гипосульфита; 0,08 — количество кислорода, эквивалент- ное 1 мл 0,01 К-раствора, Ма28203(при расчете в мл/л эквивалент = 0,56); У — объем пробы, взятой на титрование; 2 — объем прибавленных при фиксации реактивов [МпС1 2+ +(КЛ+КаОН)] (по 1 мл); 1000 —пересчет на 1 л.
В том случае, если на титрование из склянки берут 100 мл испытуемой воды, общая расчетная формула упрощается и приобретает вид: 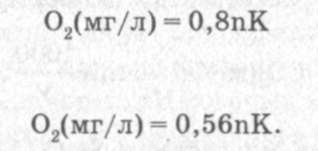
Определение свободной углекислоты (С02). Углекислота в воде прудов бывает в нескольких видах: свободная углекислота (С02), бикарбонаты и монокарбонаты. Все эти соединения находятся между собой в равновесии. Свободная углекислота попадает в воду из атмосферы, но главный ее источник — окисление органических веществ и дыхание водных организмов. Чем интенсивнее протекают окислительные процессы, тем больше накапливается в воде свободной углекислоты. Содержание ее в воде является косвенным показателем загрязнения водоема органическими веществами. В больших количествах свободная углекислота является ядом для водных организмов. Показателем опасного загрязнения прудов является концентрация свободной углекислоты, превышающая 10 мг/л летом и 20 мг/л зимой. Для определений свободной углекислоты в склянки с притертой пробкой емкостью 100-150 мл набирают воду с такой же предосторожностью, как и при определении кислорода. Определение надо проводить на водоеме или немедленно при доставке пробы в лабораторию. Пипеткой Мора отбирают 100 мл воды в колбу. В воду добавляют 1-2 мл 0,1% -ного раствора фенолфталеина (или 3 капли 1% -ного) и хорошо перемешивают круговыми движениями. Если после добавления фенолфталеина вода окрасится в розовый цвет, то отмечают, что свободной углекислоты нет. Если вода в колбе осталась бесцветной, в ней определяют свободную Углекислоту титрованием пробы раствором соды (Ка2С03) или щелочи (ШОН) до тех пор, пока исчезающая вначале розовая окраска не станет устойчивой. Количество соды Ка2С03 в мг-экв, ушедшее на реакцию с содержащимся в данном объеме воды С02, определяется произведением израсходованного количества раствора Ка2С03 в миллилитре на его нормальность. 1 мл 1 К-раство-ра Ш2С03, т. е. 1 мг-экв, соответствует 44 мг С02. В пересчете на 1 л воды расчеты ведут по формуле: С02(мг/л) = 44пг4^^, У где п — количество, мл, раствора N82003; N — нормальность данного раствора №2С03; У — объем воды, взятой для определения; 1000 — пересчет на литр. При У =200 мл и точно 0,02 1Ч-растворе N82003формула упрощается: С02(мг/л)=4,4п, а при У = 100 мл и 0,02 ^растворе N82003 С02(мг/л) = 8,8п. Определение рН воды. В пресных водоемах рН изменяется в пределах примерно от 4,5 до 9,5 и выше. На величину рН в водах, содержащих значительное количество гумусовых веществ, вымываемых из болот и лесных почв, большое влияние оказывает диссоциация органических кислот (одного из главных компонентов гумусового комплекса болотных вод). Поэтому железистым и болотным водам свойственно понижение величины рН, нередко ниже 4,0. Многие сточные воды сильно сдвигают рН как в кислую, так и в щелочную сторону. Наиболее желательна для разведения рыбы вода, рН которой колеблется в пределах от 7,2 до 8,3. Допустимая нижняя граница рН для карповых прудов составляет 6,5. Более кислую воду можно использовать для питания карповых рыбоводных прудов лишь после нейтрализации ее известью. Проще всего активную реакцию воды можно определить при помощи индикаторной лакмусовой бумажки с разными пределами измерения рН. При этом полоску индикатор- ной бумаги опускают в исследуемую жидкость на 1-2 мин, а потом сравнением цвета намоченной полосы бумаги со шкалой находят значение рН. Более точно можно определить рН воды калориметрическим методом, основанным на способности некоторых красящих веществ (органических) изменять свой цвет (двухцветные индикаторы) или густоту окраски (одноцветные индикаторы) в зависимости от концентрации водородных ионов в воде. Возникающую при добавлении индикатора окраску испытуемой воды сравнивают со шкалой цветности стандартных растворов, рН которых известны. Подробное определение рН воды описывается в инструкции, прилагаемой к набору индикаторов. Электрометрическим методом определения рН в воде можно определить значение рН почти мгновенно, что позволяет подробно и с большей достоверностью проследить динамику изменений воды. Методика электрометрического определения рН подробно описывается в инструкциях, прилагаемых к соответствующим приборам (рН-метрам). Для определения активной реакции воды используют следующие приборы: лабораторный рН-метр (ЛПУ-01), лабораторный рН-метр-милливольтметр рН-340, переносной рН-метр повышенной точности рН-47, рН-метр-милливоль-тметр рН-121, зонд ионометрический И-103 и др. Определение жесткости воды. Общая жесткость природной воды свидетельствует о содержании в ней катионов двухвалентных щелочноземельных металлов, прежде всего кальция и магния. Эти элементы попадают в воду при растворении карбонатов или в результате биохимических процессов, происходящих в верхних слоях почвенного покрова. Жесткость воды может колебаться в широких пределах. Для рыбоводных прудов слишком мягкая вода с низкой жесткостью нежелательна. Чтобы обеспечить потребность водных организмов в Са и Mg, необходима вода, жесткость которой не ниже примерно 2 мг-экв/л, или 5 Н. Воду с меньшей жесткостью рекомендуется известковать. |